Метод стимуляции неоангиогенеза миокарда на модели хронической ишемической болезни сердца у собак
Жигарев С.Н. Ларионов П.М. Федоренко А.Н. Ветеринарная клиника «Бибимон» ООО «НПФ БиоПро» ГУ Новосибирский НИИ патологии кровообращения им. Академика Е.Н. Мешалкина.
По статистическим данным, болезни сердечно-сосудистой системы занимают ведущее место среди болезней незаразной этиологии и являются основной причиной смертности (43%). Выделяют болезни, развившиеся на фоне врожденных пороков и приобретенные. Врожденные пороки проявляются очень рано и составляют всего лишь 2,4 % общего количества сердечнососудистых патологий. Собаки с врожденными пороками сердечно-сосудистой системы долго не живут. Частыми причинами преждевременной гибели старых животных бывают приобретенные болезни: кардиомиопатии (23 %), поражения створок атриовентрикулярных клапанов (11 %). Ведущую роль в возникновении основных заболеваний сердца у домашних животных играют коронарогенные поражения миокарда.
Расстройства коронарного кровообращения приводят к ишемическим, некротическим или фиброзным изменениям миокарда. В связи с этим, изучение патогенеза и обоснование принципов профилактики и лечения ишемических повреждений сердца, остается актуальным. Для практикующих врачей важны и критерии ранней диагностики ишемической болезни сердца (ИБС). Считается, что обширных коронарогенных инфарктов, развивающихся на фоне ишемической болезни сердца, у собак не бывает, так как этому виду животных несвойственны атеросклероз сосудов, гипертоническая болезнь, нервные перегрузки. Известны единичные случаи обширных инфарктов миокарда в связи со множественной тяжелой травмой; вследствие снижения коронарного кровотока при массивной кровопотере и объема циркулирующей крови (гиповолемии), при эмболии коронарных сосудов эмболами, оторвавшимися от створок аортального клапана при септическом эндокардите. Однако само по себе нарушение трофики миокарда как сопутствующее явление застойной кардиомиопатии, гипертрофии миокарда при пороках атриовентрикулярных клапанов встречается довольно часто — в 26,4 % случаев.
Целью нашей работы и сотрудничества с кардиохирургами гуманитарной медицины, являлось изучения возможности применения новейших научных разработок в области кардиохирургии в условиях ветеринарной клиники. А так же изучение эффективности комбинированного метода стимуляции неоангиогенеза у собак, при болезнях сопровождающихся дегенеративными процессами в миокарде и гибелью сосудов коронарного русла.
Материалом исследования являлись 12 собак, которым выполнялась модель инфаркта миокарда, по стандартной процедуре, со сроком постинфарктного периода от 29 до 48 суток. После этого выполнялась собственно эксперементальная часть работы. Комбинированный способ стимуляции неоангиогенеза включал в себя: имплантацию внутренней грудной артерии (arteria intermedia toracis) в миокард бассейна дистального поражения коронарного русла, лазерную реваскуляризацию зоны рубцовых изменений и периочаговой зоны, аутотрансплантация стволовых клеток в полости лазерных каналов.
Описание эксперимента. Этап I – хирургическое моделирование инфаркта миокарда: в условиях интубационного наркоза, проводилась левосторонняя боковая торакотомия по 4-5 межреберью. После вскрытия плевральной полости перикарда, на работающем сердце выделялась и лигировалась передняя нисходящая коронарная артерия, в ее средней трети, с перевязыванием ее ветвей для исключения перетоков. Манипуляция выполнялась под постоянным мониторированием ЭКГ до достижения показателей инфаркта миокарда. Операция завершалась послойным ушиванием торакотомной раны с эвакуацией остаточного воздуха по временному дренажу.
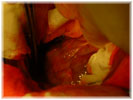
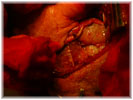
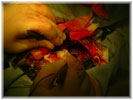
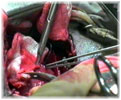
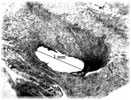
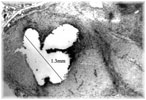
Этап II (экспериментальная часть). Торакотамия проводилась аналогично первому этапу. Работающее сердце выделялось из спаек, визуально определялась область сформированного инфаркта миокарда, который как правило распологался по передней стенки левого и правого желудочков и включал переднюю часть межжелудочковой перегородки. Далее выделялась левая внутренняя грудная артерия. Причем выделение выполнялось в «футляре», с минимальной травматизацией артерии. Основной этап операции выполнялся на работающем сердце с использованием стабилизатора «Octopus» . Проводили «скелетизацию» дистального сегмента артерии на протяжении не менее 2 см. В выбранной зоне проводили линейное рассечение эпикарда на протяжении 1,5-2 см. Следующим этапом формировали анастомоз внутренней грудной артерии в миокард непрерывным обвивным швом. Имплантацию артерии проводили на всем протяжении рассеченного эпикарда. Перед герметизацией последние 5-6 стежков ослабляли и создавали в зоне анастамоза под визуальным контролем сообщающиеся с полостью левого желудочка лазерные каналы диаметром 0,3 мм. Для формирования каналов использовали полупроводниковый импульсный лазер мощностью 9 Вт. Затем создавали радиальные лазерные каналы, в направлении от анастамоза к ишемизированному миокарду. Далее на заключительном этапе проводили имплантацию стволовыми клетками в полости лазерных каналов, в дозе 0,2 мл на канал, при концентрации стволовых клеток 2 млн/мл. На область лазерного отверстия со стороны эпикарда накладывался кисетный атравматический шов (Этикон-7.0). Отмечено, что при выполнении радиальных каналов, для остановки кровотечения было достаточно компрессии тупфером со стороны эпикарда. Результаты оценивались методом перфузионной томосцинтиографией, и у части пациентов проведена эвтаназия и исследованы гистологические срезы. При томосцинтиографии выявлено улучшение перфузии миокарда периочаговой зоны от 6 до 17%. При гистологическом исследовании в сроки 34 и до 48 суток, на всем протяжении канала, мог наблюдаться четкий просвет с явлениями формирования стенки канала по типу «толстостенных» сосудов, с эндотелизацией. Кроме «магистальных» ТЛК в этих же наблюдениях мог определяться другой тип васкуляризации — «рассыпной» с подчеркнутым неоваскулогенезом. Который характеризовался появлением большого количества мелких артерий интрамурального калибра в сочетании с картиной напоминающей гемангиому, где выявлялись сосудистые «почки». В срок 5 дней после ТЛК преобладали альтеративно-тромботические изменения в зонах выполнения процедуры. Морфологический анализ показал наличие двух типов неоваскулогенеза рубцовой зоны миокарда при проведении процедуры непрямой лазерной реваскуляризации – «магистральный» и «рассыпной».
Необходимо проведение дополнительных исследований для уточнения условий вариантов неоваскулогенеза.
Модель лазерного скальпеля ЛС-1,56- «ИРЭ-ПОЛЮС» является адаптированным хирургическим инструментом для проведения непрямой лазерной реваскуляризации на работающем сердце у собак.